近日,為應對疫情爆發(fā)期間的個人防護用品以及醫(yī)療器械的短缺問題,美國發(fā)布EUA(應急使用授權),前提是要確保產(chǎn)品達到足夠的健康和安全水平。
目前已經(jīng)列入EUA的包括(新冠檢測試劑、口罩、呼吸機設備等),EUA名錄持續(xù)更新中。
美國醫(yī)療器械是由食品藥品監(jiān)督管理局(FDA)管理批準上市。
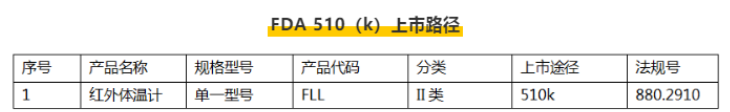
醫(yī)用口罩、電子體溫計、紅外體溫計(額溫槍)都屬于Ⅱ類醫(yī)療器械,需要按FDA510_(k)方式申請。
EUA只是加快了產(chǎn)品審核流程
在體溫計還沒有被列入EUA的當下
訊科商品檢驗建議:
無論EUA名錄如何變動,產(chǎn)品都以合規(guī)為前提,體溫計生產(chǎn)商應提前啟動FDA合規(guī)準備工作(產(chǎn)品檢測+FDA510(k)文件準備),一旦應急上市途徑明確,在產(chǎn)品合規(guī)的前提下,產(chǎn)品通過FDA EUA)應急審批即可出貨清關。
訊科商品檢驗能提供
體溫計FDA\CE等加急檢測服務歡迎咨詢!
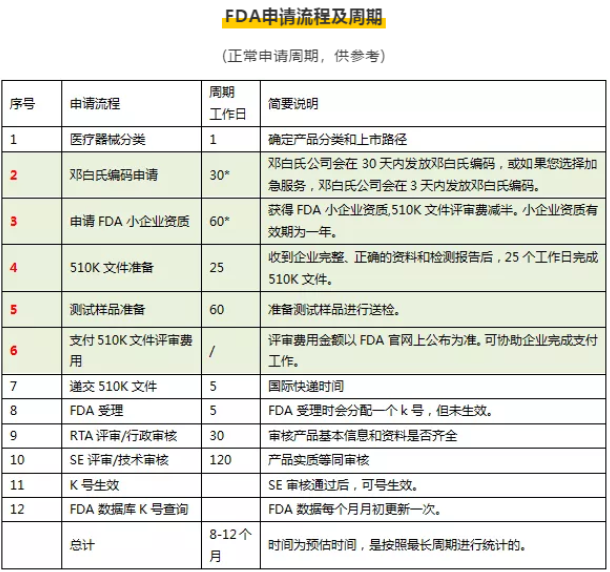
FDA510(k)申請流程
1.FDA510(k)文件準備2.產(chǎn)品檢測---510(k)遞交申請
3.FDA根據(jù)產(chǎn)品類型提交需要注冊的資料清單
4.企業(yè)按要求遞交相關資料
5.FDA對其進行審批
6.企業(yè)根據(jù)要求進行整改
7.FDA最終做出決定
8.獲得批準k號生效
根據(jù)FDA官方的規(guī)定,適用的產(chǎn)品代碼如下:
1.外科口罩(FXX)
2、帶有抗菌劑抗病毒劑的外科口罩(OUK)
3、兒科兒童口罩(OXZ)
4、手術服(FYA)
5、隔離服和或者配件(FYC,LYU,OEA))
6、外科服(FXO)
7、體溫計(FLL)
例:額溫槍FDA510(k)上市路徑
上一篇:醫(yī)療器械CE認證流程是什么?
下一篇:NIOSH認證暫時被EUA(緊急使用授權)認證替代,KN95口罩EUA緊急使用授權
- 海灣七國GCC認證常見疑問解析
- NCCS宣布光網(wǎng)絡終端和光線路終端安全認證的強制日期
- 國家認監(jiān)委批準《汽車芯片認證審查 通用技術要求》等5項認證認可行業(yè)標準
- 歐盟擴大REACH附錄XVII 多環(huán)芳烴(PAHs)的限制 范圍!
- 歐盟發(fā)布化學和相關活動的實驗裝置標準EN 71-4:2020+A1:2025
- 加拿大ISED認證收費標準調(diào)整要注意什么
- ECHA發(fā)布REACH PFAS限制提案最新進展
- 國家衛(wèi)生健康委發(fā)布5項食品接觸材料新標準及1項標準修改單
- 服裝及鞋襪國際RSL管理(AFIRM)2025版限用物質清單測試介紹
- 雙標”+監(jiān)督辦法三重升級!2025食品標簽新規(guī)亮點解析



